Oceaanverzuring wordt door sommigen ‘het andere CO2 probleem’ genoemd en soms zelfs de ‘kwaadaardige tweeling van de opwarming van de aarde’. De Engelse term ocean acidification wordt ook vaak gebruikt. Met enige regelmaat wordt men in discussies geconfronteerd met allerlei misvattingen of vragen omtrent de oceaanverzuring. Hieronder pogen we voor de meest voorkomende vragen een aantal antwoorden en uitleg te geven. Deze zijn voor het grootste gedeelte gebaseerd op het “FAQs about Ocean Acidification” rapport uit 2012 en het rapport uit 2013 van het derde symposium over “The Ocean in a High-CO2 World”. Meer info en veel wetenschappelijke referenties zijn in die rapporten te vinden en op hun websites, zie de ‘Wetenschappelijke referenties en links’ onderaan het blogstuk.
1. Wat is oceaanverzuring?
2. Is oceaanverzuring hetzelfde als klimaatverandering?
3. Waarom noemt men het oceaanverzuring terwijl de oceanen basisch zijn?
4. Welke chemische reacties spelen een rol in de oceanen als het over CO2 gaat?
5. Waarom wordt er door de CO2 opname niet spontaan calciumcarbonaat gevormd?
6. Zijn er metingen die aantonen dat de pH daalt?
7. Hoeveel is de pH (zuurgraad) gedaald sinds de industriële revolutie?
8. Waarom is men bezorgd over de oceaanverzuring?
9. De natuurlijke variatie in de pH van de oceanen is groter dan de verwachte daling van de pH in de komende eeuw, waarom is dat laatste dan toch een punt van zorg?
10. Blijven de oceanen zoveel menselijk CO2 opnemen zoals nu het geval is?
11. Wat is de verwachting voor de toekomst voor de chemische samenstelling van de oceanen?
12. Hoe zullen de verschillende soorten reageren op de oceaanverzuring?
13. In het geologische verleden was de CO2 concentratie in de atmosfeer soms erg hoog en toch waren er koraalriffen en ander leven met een kalkskelet in de oceanen. Hoe kan dat?
Wetenschappelijke referenties en links.
Oceaanverzuring is een daling van de zuurgraad van de oceanen over decennia of langer. De oorzaak daarvan is meestal een opname van CO2 uit de atmosfeer; CO2 vormt in combinatie met water namelijk koolzuur (H2CO3). In het geologische verleden van de aarde is oceaanverzuring vaker voorgekomen en door natuurlijke oorzaken. Dit keer zijn wij mensen er de veroorzakers van, want in de huidige tijd neemt de hoeveelheid CO2 in de atmosfeer sterk toe door de verbranding van fossiele brandstoffen.
De zuurgraad wordt in de chemie aangeduid met de pH en dat is een logaritmische schaal (pH = – Log[H+]): een vloeistof met een pH van 5 is dus tien keer zo zuur als die met een pH van 6. Een pH van 7 noemt men neutraal, een hogere pH noemt men basisch en een lagere pH zuur. De pH van de oceanen varieert van circa 7.8 tot 8.4 (IPCC AR5, blz. 293) en is gemiddeld 8.1, de oceanen zijn derhalve licht basisch.
Nee, klimaatverandering is de verandering van het gemiddelde weertype of klimaat over een bepaalde periode. Klimaatveranderingen kunnen veroorzaakt worden door een wisselwerking van natuurlijke processen of externe verstoringen veroorzaakt door zowel natuurlijke als menselijke invloed. De stijging van de CO2 concentratie in de atmosfeer is een van deze menselijke invloeden en is een van de belangrijkste oorzaken van de huidige opwarming van de aarde.
Oceaanverzuring betreft de verandering in de chemische samenstelling van de oceanen en de daarmee samenhangende daling van de zuurgraad. Zowel klimaatverandering als oceaanverzuring hebben een mondiaal karakter.
De naam verzuring geeft de richting aan waarin de zuurgraad van de oceanen verandert. Hoewel de oceanen licht basisch zijn, worden ze door de opname van CO2 steeds zuurder, of zo men wilt, minder basisch. De opname van CO2 leidt tot de vorming van koolzuur (H2CO3) in de oceanen en, zoals de naam al zegt, dat is een zuur. Hierdoor stijgt de concentratie aan waterstof-ionen (H+) en daarmee daalt de pH. Het woordgebruik is vergelijkbaar met het gebruik van ‘warmer worden’: als het buiten -20 °C is en de temperatuur stijgt naar 0 °C is het nog steeds koud en toch zeggen we dat het warmer is geworden.
Als CO2 oplost in de oceanen wordt in eerste instantie koolzuur gevormd, dat echter snel uiteenvalt in het zogenaamde bicarbonaat-ion (HCO3–) en een waterstof-ion (H+). In water is geen los waterstof-ion aanwezig maar is het gekoppeld aan een watermolecuul en vormt dan H3O+.
2. H2CO3 (koolzuur) ↔ HCO3– (bicarbonaat-ion) + H+(waterstof-ion)
De toename van de concentratie aan waterstof-ionen zorgt ervoor dat de pH daalt. Er is echter nog een derde reactie in het spel. Het bicarbonaat-ion kan uiteenvallen in een zogenaamd carbonaat-ion (CO32-) en opnieuw een waterstof-ion.
De dubbele pijl in de reactievergelijkingen geeft aan dat er sprake is van een evenwicht. De ligging van deze evenwichten en dus van de verhouding in de concentraties van de verbindingen, is van vele zaken afhankelijk, zoals de druk in het water, de temperatuur en het zoutgehalte. Deze relaties zijn in de chemie erg goed bekend en men kan daaruit bijvoorbeeld uitrekenen dat bij een pH van 8.2 de concentraties aan opgelost kooldioxide, bicarbonaat-ionen en carbonaat-ionen in zeewater respectievelijk 0.5%, 89% en 10.5% van het totaal zijn. Dit geeft aan dat het grootste gedeelte van het opgeloste CO2 in de vorm van bicarbonaat-ionen aanwezig is en niet als CO2. Het gehele systeem werkt als een chemische buffer, de meeste waterstof-ionen die door het oplossen van CO2 vrij zouden kunnen komen, worden vastgelegd in de vorm van bicarbonaat. De verhouding van de concentraties van CO2, HCO3– en CO32- in zeewater als functie van de pH is weergegeven in onderstaande figuur, een zogenaamd Bjerrum plot.

Bron: Wikipedia
Een gevolg van de toename van de CO2 concentratie in de atmosfeer is dat de zuurgraad in de oceanen stijgt, maar ook dat de concentratie aan carbonaat-ionen daalt. Veel zeeorganismen maken een kalkskelet aan en dat bestaat uit het zogenaamde calciumcarbonaat (CaCO3). Dat gaat volgens de volgende reactie:
Als de carbonaat-ion concentratie te laag wordt, zullen calciumcarbonaat verbindingen in de oceanen spontaan oplossen. In de bovenste laag van de oceanen is de concentratie aan carbonaat-ionen dermate hoog dat er sprake is van een zogenaamde oververzadiging waardoor de kalkskeletten kunnen blijven bestaan. Deze verzadigingsgraad voor calciumcarbonaat verbindingen duidt men aan met de Griekse letter Ω. Een Ω kleiner dan 1 betekent dat calciumcarbonaat verbindingen spontaan oplossen en een Ω groter dan 1 staat voor een oververzadiging. Naarmate de Ω lager wordt zullen zeeorganismen over het algemeen meer energie moeten verbruiken om hun kalkskelet aan te maken, ook al is de absolute waarde nog steeds groter dan 1 (en er dus sprake is van oververzadiging). Er zijn twee soorten calciumcarbonaat verbindingen waaruit de kalkskeletten kunnen bestaan, namelijk aragoniet en calciet. Van deze twee heeft aragoniet de hoogste oplosbaarheid in zeewater en daarmee een lagere Ω dan calciet.
In zeewater zitten naast opgelost keukenzout (NaCl) ook diverse andere ionen en elke kilogram zeewater bevat bijvoorbeeld circa 0,13% magnesium dat in opgeloste vorm aanwezig is als het magnesium-ion Mg2+. Deze magnesium ionen verhinderen de spontane vorming van calciumcarbonaat kristallen, ook al is het zeewater oververzadigd voor calciumcarbonaat. Behalve op speciale plaatsen is het verwijderen van carbonaat-ionen voor het aanmaken van een kalkskelet alleen op biologische wijze mogelijk. De complexe samenstelling van zeewater maakt dus dat het wat anders gaat dan je op basis van basis-chemie zou verwachten.
Referentie: Rushdi 1992.
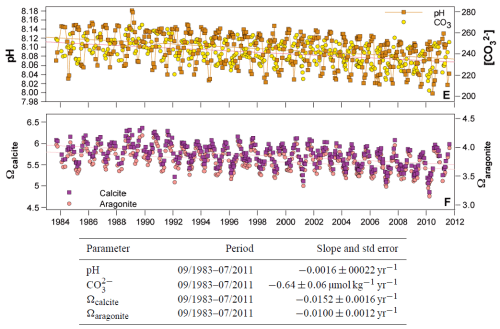
De langst lopende metingen aan de chemische samenstelling van het zeewater zijn de metingen van de Bermuda Atlantic Time-series Study (BATS) en de Hawaii Ocean Time-series (HOT). De figuur hieronder bevat enkele metingen van BATS, afkomstig uit Bates 2012. De daling van de pH is daar 0,0016 pH eenheden per jaar, dat is een daling van de zuurgraad met 0,37% per jaar. De gegevens van HOT zijn op hun website in te zien (kies ‘pH comparison’).
Gebruik makend van onze kennis van de chemische evenwichten met betrekking tot de opname van CO2 in de oceanen, de analyse van de CO2 concentratie in ijskernen en de huidige chemische samenstelling van de oceanen is het mogelijk om het verschil in de gemiddelde pH te berekenen van de oceanen voor het industriële tijdperk en de huidige tijd. Het IPCC vermeldt in hun AR5 rapport een daling van de pH van 8,2 naar 8,1, circa 0,1 eenheden (blz . 295). Het “FAQs about Ocean Acidification” rapport is wat preciezer en vermeldt een daling van de pH van 8,21 naar 8,1: 0,11 eenheden. Een daling van de pH met 0,1 – 0,11 eenheden komt vanwege de logaritmische relatie overeen met een stijging van de zuurgraad met circa 26 – 29%.
Zie ook Orr 2005 en een overzicht van de Royal Society uit 2005 (blz. 9).
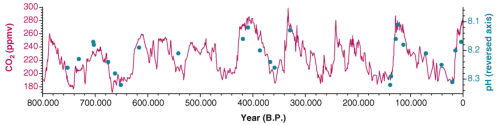
De figuur hieronder is afkomstig uit Pelejero 2010 en geeft de CO2 concentratie in de atmosfeer weer gedurende de laatste 800.000 jaar (linker as). De blauwe punten in die grafiek zijn reconstructies van de pH van het zeewater (rechter as: de laagste pH waarde, overeenkomend met de meest zure toestand, staat bovenaan). De pH van de oceanen heeft in die periode gevarieerd tussen circa 8,3 tot 8,1 eenheden en de huidige pH van 8,1 van de oceanen ligt dus aan de bovengrens daarvan.
Veel organismen zijn zeer gevoelig voor ogenschijnlijk kleine veranderingen in pH en dit geldt ook voor het zeeleven. Fundamentele fysiologische processen zoals ademhaling , het opbouwen van het kalkskelet, de fotosynthese en de voortplanting reageren op de omvang van veranderingen in CO2 concentraties in zeewater, samen met de daaruit voortvloeiende veranderingen in pH en de concentraties aan carbonaationen die de komende eeuw verwacht worden. Onderzoek heeft aangetoond dat dit negatieve gevolgen kan hebben voor verschillende organismen die in de oceanen leven.
In de afgelopen 300 miljoen jaar zijn er enkele perioden op aarde geweest waarin een sterke verzuring van de oceanen heeft plaatsgevonden. In die perioden nam de biodiversiteit in de oceanen behoorlijk af, zie de 1e figuur hieronder afkomstig uit Hönisch 2012. De 2e figuur hieronder komt uit een IGBP Powerpoint presentatie en geeft de effecten van de oceaanverzuring (‘business-as-usual’ scenario) weer op commercieel en ecologisch belangrijke groepen van zeeorganismen.
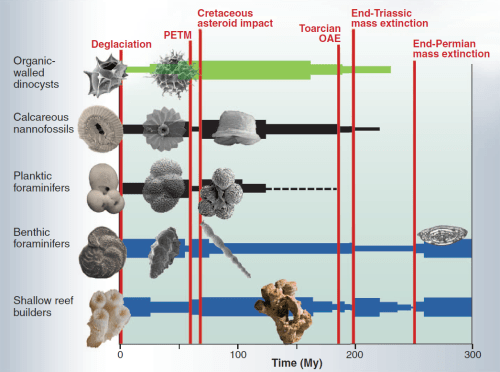
De dikte van de horizontale lijnen geeft de mate van biodiversiteit weer. De huidige snelheid van de oceaanverzuring is circa 10 tot wellicht 100 keer hoger dan tijdens eerdere perioden met oceaanverzuring (de rode verticale lijnen). De x-as geeft aan hoe lang geleden de weergegeven gebeurtenissen plaatsvonden. Links is het heden.
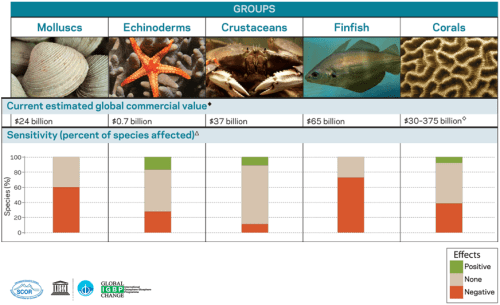
De commerciële waarde van de zeevisserij voor de verschillende groepen van zeedieren (weekdieren, stekelhuidigen, kreeftachtigen, zeevissen, koraal) is gegeven in Amerikaanse dollars (2010). De gevoeligheid van deze groepen voor oceaanverzuring is gebaseerd op Wittmann and Pörtner, 2013. Meer informatie en een uitgebreidere figuur is te vinden in het IGBP rapport.
De natuurlijke variatie in de zuurgraad van het zeewater (en dus de pH) is relatief groot over dagen, weken of zelfs maanden. Deze korte termijn variabiliteit kan veel groter zijn dan de huidige en verwachte toekomstige oceaanverzuring. De reden dat wetenschappers bezorgd zijn over die langzame, lange termijn verandering is dat het omgevingsgemiddelde, de basislijn, verschuift. Dit betekent dat de natuurlijke variaties in zuurgraad door fotosynthese, respiratie, opwelling, en vele andere processen plaatsvinden tegen de achtergrond van een steeds toenemende gemiddelde concentratie van waterstofionen. Ook al is deze verandering in de basislijn langzaam op een menselijke tijdschaal: de verandering is zeer snel ten opzichte van de geologische tijdschaal. De huidige verzuring van de oceanen gaat sneller dan de historische veranderingen in de zuurgraad van de oceanen over de afgelopen 300 miljoen jaar. Het gevolg hiervan is dat organismen die een bepaalde nauwe range van condities gewend zijn steeds vaker geconfronteerd zullen worden met stressvolle of zelfs dodelijke omstandigheden.
De oceanen nemen nu circa 25-30 procent van het uitgestoten CO2 op en hiermee helpt de natuur dus om een nog sterkere opwarming te voorkomen. De verwachting is echter dat de temperatuur van de oceanen in de toekomst zal stijgen en bij een hogere temperatuur is de oplosbaarheid van CO2 in het zeewater lager. Hierdoor zal de opname van CO2 een beetje afnemen. Bijvoorbeeld: als de oceaantemperatuur constant zou blijven, zou een verdubbeling van de CO2 concentratie in de atmosfeer van 260 naar 580 ppm leiden tot een toename van de hoeveelheid opgeloste koolstof van 2002 tot 2131 micromol per kg zeewater. Als tevens de temperatuur van het zeewater met 2 °C zou stijgen zou de toename van de opgeloste koolstof beperkt blijven tot 2117 micromol per kg zeewater. Oftewel een stijging van de temperatuur van het zeewater met 2 °C zou de opname van CO2 met 10% doen dalen.
Het belangrijkste proces voor de opname van CO2 door de oceanen is het chemische opname vermogen via de diverse carbonaat-ion reacties (zie FAQ vraag 4). Door de daling van de concentratie aan carbonaat-ionen zal dit opname vermogen afnemen, een maat voor dit chemische opname vermogen is de zogenaamde Revelle factor. Hoe hoger deze factor, hoe lager het opnamevermogen. Sinds de industriële revolutie is dit chemische opname vermogen al gedaald (Sabine 2004) en zal in de toekomst verder dalen.
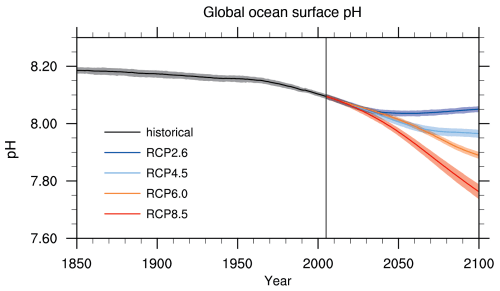
De toekomst van de oceanen is in onze handen. Afhankelijk van de hoeveelheid fossiele brandstoffen die wij mensen de komende eeuwen zullen verbranden en de daarmee gerelateerde toename van de CO2 concentratie in de atmosfeer, zal de chemische samenstelling van de oceanen veranderen. De zuurgraad zal stijgen, en daarmee dus de pH dalen, en daarnaast zullen de oceanen langzaam maar zeker meer corrosief worden voor de calciumcarbonaat verbindingen waaruit de kalkskeletten van de zeeorganismen zijn opgebouwd. In de 1e figuur hieronder uit het IPCC AR5 rapport is voor diverse toekomstscenario’s de daling van de pH van de oceanen weergegeven tot het jaar 2100. Het RCP8.5 scenario is het scenario dat de mensheid qua CO2 emissies nu zo ongeveer volgt. In de 2e figuur hieronder uit het IGBP rapport is de pH en de verzadigingsgraad Ω van aragoniet (een calciumcarbonaat verbinding) weergeven voor het jaar 1850 (links) en voor het jaar 2100 (rechts) gebaseerd op het RCP8.5 scenario.
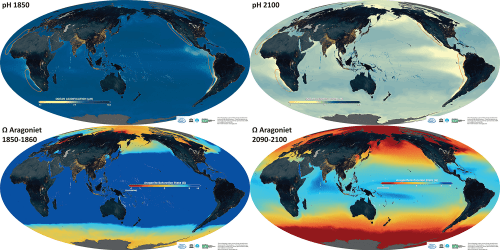
Linksboven de pH van de oceanen in 1850 en linksonder de aragoniet verzadigingsgraad voor 1850-60. Rechtsboven de pH van de oceanen in 2100 en rechtsonder de aragoniet verzadigingsgraad voor 2090-2100 (IPCC RCP8.5 scenario).
Hoewel veel soorten nadelige gevolgen zullen ondervinden van de oceaanverzuring, zullen er ook soorten zijn die er voordeel bij zullen hebben. De meeste studies laten zien dat negatieve effecten zullen optreden bij veel calcificerende organismen, zoals koralen, foraminifera, weekdieren en kreeftachtigen; hierbij zijn de weekdieren zoals mosselen het meest gevoelig voor oceaanverzuring. Op hogere breedtegraden zijn de oceanen al corrosief voor sommige soorten, bijvoorbeeld in delen van de Zuidelijke Oceaan lossen de schelpen van kleine zeeslakken (pteropods) al op vanwege de lagere verzadigingsgraad. Als de CO2-emissies op deze wijze doorgaan, zal ergens deze eeuw de erosie van koraalriffen sneller verlopen dan de opbouw ervan. Een hogere CO2 concentratie in de oceanen werkt positief uit voor sommige zeegrassen, algen en fytoplankton groepen.
De gevarieerde respons van vele zeeorganismen op de oceaanverzuring en de opwarming van de oceanen zal waarschijnlijk leiden tot belangrijke veranderingen in de diverse ecosystemen in de oceanen. Dat dit gevolgen voor de mens zal hebben moge duidelijk zijn. Meer dan een miljard mensen op aarde zijn voornamelijk afhankelijk van de zeevisserij voor hun eiwitinname. Tropische koraalriffen worden wel de ‘tropische regenwouden van de oceaan’ genoemd vanwege de hoge biodiversiteit aldaar. Die biodiversiteit komt met verdergaande verzuring dus onder druk te staan.
Als de oceanen verzuren, zal uiteindelijk het oplossen van calciumcarbonaat-verbindingen ervoor zorgen dat de concentratie aan carbonaat-ionen in de oceanen weer stijgt. Hierdoor verschuiven langzaam (d.w.z. over duizenden jaren) weer alle chemische evenwichten waardoor ook de zuurgraad van de oceanen weer af zal nemen. Dit mechanisme zorgt ervoor dat de oceanen ook bij hoge atmosferische CO2 concentraties toch een wat lagere zuurgraad kunnen hebben en tevens een relatief hoge verzadigingsgraad voor aragoniet en calciet (Zeebe 2012, blz. 145), de calciumcarbonaat-verbindingen waaruit de kalkskeletten van de zeeorganismen bestaan. Dit ‘pH compensatie’ proces noemt men “carbonate compensation”. Het nadeel is echter dat dit terugkoppelingsproces langzaam is en speelt op een tijdschaal van 5.000 tot 10.000 jaar (Ridgwell en Zeebe 2005, blz. 305).
Het rapport “FAQs about Ocean Acidification” is van het OCB/UKOA, dat zijn onderzoeksprogramma’s van de VS en het Groot-Brittannië. Aan het OCB/UKOA rapport hebben 63 wetenschappers meegewerkt.
Website: http://www.whoi.edu/website/OCB-OA/FAQs
Het derde symposium over “The Ocean in a High-CO2 World” is gesponsord door een aantal organisaties met de afkortingen IGBP, IOC-UNESCO en SCOR. Aan dat internationale symposium hebben maar liefst 540 wetenschappers deelgenomen.
Website: http://ocean-acidification.net/
De wetenschappelijke referenties voor de rapporten zijn:
• Cooley, S., Mathis, J., Yates, K, and Turley, C. eds. Frequently Asked Questions about Ocean Acidification. U.S. Ocean Carbon and Biogeochemistry Program and the UK Ocean Acidification Research Programme. Version 2. 24 September 2012. (pdf)
• IGBP, IOC, SCOR (2013). Ocean Acidification Summary for Policymakers – Third Symposium on the Ocean in a High-CO2 World. International Geosphere-Biosphere Programme, Stockholm, Sweden. (pdf)
Andere posts op Klimaatverandering over oceaanverzuring:
• Oceaanverzuring 56 miljoen jaar geleden
• Oceanië – een zee van verandering
• Een warme en zure toekomst?
Overige links:
• “OA is not OK” op SkepticalScience
• EPOCA: European Project on OCean Acidification





Ik heb toch echt tijdens mijn scheikundeles geleerd dat als een basische oplossing richting 7 gaat dit neutraliseren heet.
LikeLike
@Hans Erren
Op het NRC heb je in 2013 precies dezelfde soort opmerking gemaakt en dat was keurig voorspeld door Bob:
http://www.nrc.nl/klimaat/2013/11/15/een-zuur-stukje/#comment-21859
Hieronder een gedeelte van mijn tekst die ik daar destijds heb achtergelaten.
Neutraliseren betekent dat je de pH van een oplossing dicht bij 7 brengt door een zure oplossing minder zuur te maken of een basische oplossing minder basisch. Als je spreekt van ‘de oceanen neutraliseren’ kun je derhalve aan het woord niet zien wat er gaande is. De oceanen zijn licht basisch en door het oplossen van CO2 worden ze minder basisch, oftewel stijgt de H3O+ concentratie en daalt de pH.
Het woord verzuren dekt gewoon veel beter de lading.
LikeLike
Hans Erren is gefascineerd door de klank van een woordje, door de ‘smaak op de tong’ in plaats van door de betekenis. Hij denkt dat “neutraliseren” minder eng klinkt voor het grote publiek en dáárom wil hij het woordje verzuring — zo heet het echter als de pH van een oplossing daalt, ongeacht de beginwaarde — vooral vervangen door “neutraliseren”.
Het was op het NRC blog simpel te voorspellen dat Erren zich van dat semantische trucje zou proberen te bedienen. En zowaar, hij hield zich keurig aan het scenario. 🙂
Het is eigenlijk vooral de lagere concentratie van carbonaat-ionen CO3(2-), de lagere omega van het zeewater, die de schade aan het zeeleven veroorzaakt. En dit is een gevolg van het *tempo* waarin de CO2-concentratie in de lucht toeneemt, niet van de absolute waarde van de CO2-concentratie. Jos heeft het glashelder beschreven in punt 4 en punt 13 hierboven.
LikeLike
“Acidosis is a condition in which there is too much acid in the body fluids. It is the opposite of alkalosis (a condition in which there is too much base in the body fluids).”
http://www.nlm.nih.gov/medlineplus/ency/article/001181.htm
Hans Erren mag nu raden wanneer acidosis wordt geconcludeerd:
a) de pH van bloed is >7
b) de pH van bloed is >7.35
Uiteraard is het juist antwoord b); die verdraaide alarmistische artsen!
LikeLike
Goed en compleet overzicht, Jos, dank je zeer. Standaardwerk waarnaar verwezen kan worden wanneer de Twijfelbrigade weer eens toeslaat.
LikeLike
Jos bedankt voor de uitvoerig inleiding.
Best handig om het in FAQ-format te presenteren. Want om het geheel te overzien vergt voortgaande studie. Je kan hiermee niet stoppen na de middelbare school. 🙂
Bij het KNAW heeft in oktober 2014 Prof. Hein de Baar dit thema ook behandeld. Zijn presentatie gaat hierbij.
Klik om toegang te krijgen tot 141021minisymposiumoceanendebaar.pdf
Wat opviel was dat hij de sterke ionen van Na, Ca en CL in balans bracht met de zwakke negatieve ionen van koolzuur.
Daarnaast wees hij op vier veranderingen in de ionen-balans door verschuiving van evenwicht in de reacties. Zie page 19.
Concentraties [µmol]=[10-6mol]
jaar 1800 2100 factor
pCO2(lucht) 280 850 µatm x3
Zeewater:[HCO3-] 2080 2280
[CO32-] 130 50 /2,8
[CO2] 18 57 x3,1
[OH-] 0.76 0.26 /2,9
[H+] 0.006 0.017 x3,5
Feitelijk is dit een getalsmatige uitwerking van de Bjerrum plot.
De factor van ca drie (of x3 of /3) lijkt me toeval?
Het commentaar van de Baar is genuanceerd:
“In jaar 2100 een sterke toename van [HCO3-] en opgelost [CO2]
en sterke afname van [CO32-].
Dit is de oorzaak van een afname van het beetje [OH-] en een
toename van het nog weiniger [H+].
Echter het gehalte [OH-] blijft toch nog meer dan tienmaal het
gehalte [H+].”
Wat mij opvalt is dat er een buffer-werking is en dat toch absolute veranderingen van een factor 3 optreden. Dus toch een grote hefboomwerking.
Graag jullie beoordeling van mijn analyse.
LikeLike
Hallo Pieter,
Het was inderdaad een behoorlijke klus en dank voor je link naar de presentatie van de Baar.
Het samenspel van al die reacties is zeker lastig en naast de reacties die ik noem in vraag 4 speelt ook nog de dissociatie van boorzuur een rol. Daarbij zijn de evenwichtsconstanten ook nog eens afhankelijk van de temperatuur en het zoutgehalte. Zie bijv. tabel 1.1 in het volgende Epoca document:
http://www.epoca-project.eu/index.php/restricted-area/documents/doc_download/268-oa-guide-ch1-2010.html
Voor alle berekeningen waar de concentraties en pH dan uitrollen gebruikt men voor zover ik weet software pakketten, zoals dat CO2SYS waar de Baar naar verwijst op pagina 12 van zijn presentatie.
Een mooi, maar wat lastig leesbaar diagram kun je vinden in de referentie naar Zeebe in vraag 13. Zeebe legt het weer anders uit: er zijn 6 onbekenden ( DIC, TA, CO2, HCO3(-), CO3(2-) en H(+) ) en 4 vergelijkingen. Als twee parameters bekend zijn, kan alles mathematisch opgelost worden, zijn voorbeeld is daar een hoge CO2 concentratie en een hogere DIC dan nu en die geven samen toch een hoge verzadigingsgraad omega voor aragoniet en calciet. De situatie tijdens de krijtperiode.
De getallen op pagina 19 van de presentatie lijken mij echter niet helemaal te kloppen of ze zijn wel erg ‘ongeveer’. Vergelijk ze bijv. maar eens met tabel 1 in het rapport van de Royal Society waar ik in vraag 7 naar verwijs. Als je de verhoudingen (in %) uitrekent van die getallen op pagina 19 kom je voor 1800 op CO2 : HCO3(-) : CO3(2-) = 0.8 : 93.4 : 5.8. Dit terwijl op bladzijde 11 zo ongeveer dezelfde percentages staan als ik in vraag 4 heb genoemd, nl. 1 : 90 : 10. In 1800 was de CO2 concentratie lager en de pH circa 8.2, dus zou de CO3(2-) meer dan 10% moeten bedragen. In de tabel van de Royal Society klopt dat wel, nl daar is het percentage CO3(2-) in 1800 11.2% van de totale opgeloste hoeveelheid koolstof.
De chemische beschrijving van de Baar die jij citeert komt genuanceerd over, zijn beschrijving van de verzadigingsgraad van aragoniet op blz 22 weer niet: “Aragoniet raakt reeds eerder onderverzadigd in jaar ~2060” . Gezien het plaatje rechtsonder in vraag 11 is dat niet voor de gehele oceaan het geval.
Het is al met al inderdaad niet iets waar je mee kan stoppen na je middelbare school :).
LikeLike
Jos,
dat is een erg handzame & informatieve identi-kit van de zure sluipmoordenaar. Ik heb er uitgebreid in gegrasduind, inclusief de links die je bijlevert. Het heeft me herinnerd aan het evolutie-theoretische feit dat het aardse leven voortkomt uit de zee. En die historische relatie staat als een paal boven water: zonder de zee geen aards leven. Omgekeerd gaat dat niet op: zonder aards leven leeft de zee voort. Het is die a-symmetrie in de relatie water / vaste land die in risico-analyses van klimaatverandering (zie o.m. de lopende nrc-dialoog blog) totaal niet onderkend wordt.
LikeLike